Kinetische Modellierung
key researchers (alphabetische Reihenfolge)
Mag.in Dr.in Barbara Geist
Tel.: +43 (0)1 40400 - 57640
barbara.geist@meduniwien.ac.at
Lalith Kumar Shiyam Sundar, MSc
Tel.: +43 (0)1 40400 - 57640
lalith.shiyamsundar@meduniwien.ac.at
Dr.in Chrysoula Vraka, MSc
Tel.: +43 (0)1 40400 - 57640
chrysoula.vraka@meduniwien.ac.at
Die funktionelle Bildgebung, zum Beispiel mittels Positron-Emissions-Tomografie, ist eine nicht invasive Technik, die uns gestattet, die Biochemie im lebenden Organismus nachzuvollziehen und zu studieren. Dazu gibt es bereits eine Vielzahl von radioaktiv markierten Biomolekülen, den sogenannten Tracern, die eine Darstellung verschiedener biochemischer, physiologischer und pharmakologische Prozesse im lebenden Organismus ermöglichen. Um diese verschiedenen pharmakologischen Eigenschaften zu quantifizieren, benötigt man eine mathematische Beschreibung, d.h. ein kinetisches Modell, das die zugrundeliegenden Eigenschaften des Tracers möglichst vollständig, aber auch möglichst einfach wiedergibt. Kinetische Modelle basieren auf der Information, die man mit sogenannten dynamischen Scans erhält, also auf dem Verlauf der dreidimensional verteilten Tracer-Konzentration in einer bestimmten Körperregion über einen gewissen Zeitraum.
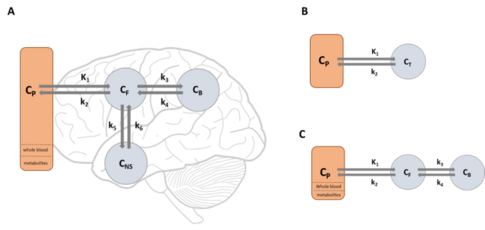
Verschiedene Verteilungsmodelle (tissue compartment models, TCM): (A) two-TCM, (B) one-TCM and (C) three-TCM. CP: Tracerkonzentration im Plasma, K1: Influxrate vom Blut ins Gewebe (Zielorgan) [mL/min/g], k2: Konstante des Effluxes vom Gewebe ins Blut, CT: Tracerkonzentration im Gewebe (Zielorgan), CF: freie Tracerkonzentration im Zielorgan, k3: kon Konstante der Zielregion (Rezeptor, Transporter etc.), k4: koff Konstante der Zielregion, CB: gebundene Tracerkonzentration der Zielregion, k5 und k6: kon und koff Konstante der nicht spezifischen Bindung, CB: unspezifische Bindung (keine Zielregion)
[Vraka Chrysoula, PhD thesis: "Predictive in vitro methods in experimental nuclear medicine: Blood Brain Barrier Penetration", 2017]
Zusammen mit geeigneten Scan-Protokollen und Rekonstruktionsalgorithmen können mit einem sinnvollen kinetischen Modell quantitative biologische Bilder erzeugt werden.
Diesen Aufgaben widmet sich ein multidisziplinäres Team in Zusammenarbeit mit der QIMP Gruppe der MUW, bestehend aus Physikern, Informatikern und Radiopharmazeuten, die sich im wissenschaftlichen Austausch mit der Quantifizierung biologischer Prozesse auseinandersetzen. Hierzu sollen neue Modelle, Korrekturmechanismen und geeignete Protokolle entwickelt werden, die individuell auf die Tracerkinetik abgestimmt sind, um dann für die klinische Anwendung etabliert zu werden. Gerade im Hinblick auf Zukunftsanwendungen wie der 4-dimensionalen Ganzkörperbildgebung braucht es zum Verständnis der biologischen Prozesse eines Körpers umfangreiches Fachwissen zu verschiedenen Fragestellungen, wie etwa zu Korrekturen bei Input-Funktionen oder bei Metaboliten.

Ausscheidungsverhalten eines zuckerähnlichen PET-Tracers (hier: FDG) in der Niere über die Zeit. Kurz nach der Injektion (p.i.) ist die Tracer-Konzentration in den Organ relativ gering. Nach etwa 30 Sekunden reichert sich der Tracer in der Niere an, schließlich ist er nur noch zentral im Nierenbecken im Zuge der Ausscheidung erkennbar. [Geist et al., Assessing the kidney function parameters glomerular filtration rate and effective renal plasma flow with dynamic FDG-PET/MRI in healthy subjects; EJNMMI, 2018]
